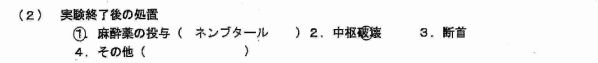2018年3月末に、防衛医科大学校に対して、開示請求で得た動物実験計画書の不明点、疑問点、改善点等に関して、質問書と提言書を送付しました。資料を以下に掲載します。
・動物実験計画書に関する質問書と提言について
・動物実験計画書に関する質問書
・動物実験計画書に関する提言
・質問書でとりあげた動物実験計画書
防衛医科大学校は防衛省に所属する機関で、「医師である幹部自衛官となるべき者を養成し、かつ、自衛隊医官に対して自衛隊の任務遂行に必要な医学についての高度の理論、応用についての知識と、これらに関する研究能力を修得させるほか、臨床についての教育訓練を行うことを目的として設立」され、「有事・災害時に発生する多数の傷病者を対象とした救命・救急医学を専門的、総合的に研究する」防衛医学研究センターや、病院、医学教育部などを有しています。(「」内記載は学校のホームページより)
開示請求で得た平成23年度から25年度の資料によれば、マウス、ラットを中心に年間8千~1万匹が入荷されており、相当な数の動物が使われていることがわかります。
特徴的なのは、行われている動物実験の内容が、一般の国立大学医学部と比較しても、動物への侵襲性の高いものが相当に多いことです。
動物実験委員会はそれなりに審査を行っているようですが、各申請者の動物福祉への意識や知識はかなり遅れているように思われます。
計画書の書式や記載内容についても相当に改善の余地があると思われますが、これは他の国立大学についてもほぼ同じです。しかし、上記のように侵襲性の高い動物実験が多く、社会的、倫理的な責任が大きいことから、今回、防衛医科大学校へ質問書を送ることにしました。
動物実験計画書の問題もさることながら、動物たちが私たち人間社会のために(少なくともそういう名目で)、国費により、人知れずこのような凄惨な研究に日々使われていることをぜひ知っていただければと思います。
2018年03月22日
防衛医科大学校長 長谷和生 殿
特定非営利活動法人 地球生物会議(ALIVE)
〒160-0008 東京都新宿区三栄町6 オグラビル203号室
TEL:03-5315-4247/FAX:03-5315-4248
E-mail:alive-office@alive-net.net
動物実験計画書に関する質問書と提言について
当会は、地球上に生息するすべての生物が尊重される社会を構築することを理念として、動物、生命、環境に関する問題の実態調査および改善提言等を行っている非営利団体です。
このたび貴校の動物実験計画書を開示請求により入手し、調査したところ、動物福祉や倫理的、科学的な観点から、不明な点や疑問点、改善点が多く見つかりました。
言うまでもなく、動物実験は動物に多大な苦痛とストレスを与える行為であり、3R原則(代替法、使用数削減、苦痛軽減)の徹底や国内外の関連基準、指針の遵守などを通して適切な動物実験の実施が求められています。また、「実験動物の飼養及び保管並びに苦痛の軽減に関する基準」(平成18年4月28日環境省告示第88号)にもうたわれていますように、昨今の動物実験には客観性と透明性の確保も求められています。さらに、貴校における研究には国民の税金が使われている観点からも、社会に対する説明責任が求められています。
つきましては、これらの件に関して、別紙の質問書を提出させていただきますので、お忙しいところ恐縮ですが、
概ね今年の9月末までを目途に文書にてご回答をいただきたく、お願い申し上げます。なお、ご回答内容につきましては、ご回答の有無を含めて当会のホームページや会誌その他に掲載させていただきますので、ご了承をお願い申し上げます。
また、このたびの調査をもとに、特に問題が多いと感じられた事項について、改善案を提言としてまとめましたので、併せて貴校における動物実験計画書の審査と運用に活かしていただきますよう、お願い申し上げます。
ご参考までに、当会が一昨年から昨年にかけて行った「動物実験計画書フォームの日米比較調査」をもとにした日本の計画書フォームへの提言(関係機関へ送付済み)も添付させていただきますので、併せてご参照ください。
また、日薬理誌の記事(「動物実験審査委員会での審議例」)も参考になりますので、添付させていただきます。
以上
<動物実験計画書に関する質問書>
貴校において平成23年度から平成25年度までに承認された動物実験計画書のうち、疑問点や改善点が目立つものを中心にピックアップしました。(なお、対象期間の計画書すべてに目を通したわけではありません。)質問事項作成にあたっては、計画書に対する動物実験委員会によるコメント及び計画書の修正内容に関する記録も参照しています。
○質問1
平成23年度 承認番号11034 研究課題名 マウス皮下腫瘍に対する光―超音波法による分子イメージング について
1-1 実験の目的が「マウスの皮下腫瘍に対して開発中の光―超音波イメージング法を適用する」となっていますが、適用して何が得られることを目的としているのでしょうか?また、最初から記載させるべきではないでしょうか?
1-2 実験概要が「光―超音波イメージング法を適用する」で終わっていますが、適用して何を観察するのでしょうか?また、それによって何が得られるのでしょうか?
1-3 「使用動物数の算出根拠」にある4条件が実験概要から読み取れませんので、ご教示ください。また、最初から記載させるべきではないでしょうか?
1-4 ヒト卵巣癌細胞株の投与時期、投与回数、時間間隔等についてご教示ください。また、最初から記載させるべきではないでしょうか?
1-5 どの処置が麻酔下の処置なのでしょうか?また、最初から記載させるべきではないでしょうか?
1-6 イメージング法適用後、動物は飼育(観察)を続けるのでしょうか?実験終了、安楽死のタイミングはどの時点でしょうか?また、最初から記載させるべきではないでしょうか?
1-7 動物の予測される症状(有害事象)とその対処法を記載させるべきではないでしょうか?
1-8 ペントバルビタールには鎮痛作用がなく、また、意識喪失の状態が得られる用量が致死量に近いため、麻酔薬としての単独使用は現在は推奨されていません。他の薬剤を用いるべきではないでしょうか?
1-9 人道的エンドポイントの条件に(委員会の指摘にも関わらず)腫瘍の大きさが含まれてないのは何故でしょうか?
1-10 当初は「実験終了後ラットを犠牲死させるため」、人道的エンドポイントを「設定しない」と理由を書いておきながら、委員会からの「人道的エンドポイントを設定する必要があります。」との意見に対し、「エンドポイントの設定に関する書類が欠如しておりました」との説明はおかしいのではないでしょうか?申請者は人道的エンドポイントを理解していなかったのではないでしょうか?(実験終了後に動物を安楽死させることは人道的エンドポイントを設定しない理由にはなりませんので。)また、「ラットを犠牲死」はマウスの間違いではないでしょうか?
1-11 人道的エンドポイントの条件が当てはまるかどうかを定期的に観察、測定する具体的プランを記載させるべきではないでしょうか?
1-12 実験概要で、実験操作は”Guide for the Care and Use of Laboratory Animal Resources(1996)に準拠して行う、とありますが、改定8版が2010年(平成22年)に出ています。こちらに準拠すべきではないでしょうか?また、”Laboratory Animal Resources”ではなく、” Laboratory Animals”です。
○質問2
平成23年度 承認番号11068 研究課題名 頸動脈狭窄症に対する血管内治療の研究 について
2-1 実験概要には「静脈麻酔のもと、前頚部を切開して・・」とありますが、メールでの質問と回答では、「鎮静、局所麻酔のもとで、頚部皮膚を切開、・・」となっています。どちらが正しいのでしょうか?
2-2 鎮静、局所麻酔を使用したとすれば、何(薬剤名)を使用されたのでしょうか?また、局所麻酔で問題ない処置なのでしょうか?
2-3 ネンブタール(ペントバルビタール)には鎮痛作用がなく、また、意識喪失の状態が得られる用量が致死量に近いため、麻酔薬としての単独使用は現在は推奨されていません。他の薬剤を用いるべきではないでしょうか?
2-4 疾患モデル作成方法の詳細、実験手技(処置)の詳細、動物の生存期間、動物の予測される症状とその対応など、委員会等から聞かれなくとも計画書に記載すべき必須事項と思われますが、如何でしょうか?
2-5 予想されるウサギの症状について、メールでの質問と回答および委員会からの質問と回答では、「頚部切開、血管露出による疼痛、感染」あるいは「頚動脈周囲にキトサンを留置する処置に伴う感染、出血」とされていますが、その対処法では「感染がひどい場合には安楽死」となっており、頚部切開、血管露出による「疼痛」あるいは「出血」に対する対処法が書かれていません。どうなっているのでしょうか?
2-6 投与物質(キトサンおよび麻酔薬)の使用量を記載させるべきではないでしょうか?
2-7 実験概要に「①及び②の実験と平行して、静脈麻酔のもと、前頚部を切開して・・」とありますが、②は安楽死後の処置であり、②と平行してキトサン留置の実験手技を行うという説明は矛盾しているのではないかと思われますが、如何でしょうか?
2-8 実験全体の流れが不明瞭です。動物への処置の観点から、各群の設定がわかるように、時系列でご説明いただけますでしょうか?また、最初からそのように記載させるべきではないでしょうか?
2-9 人道的エンドポイントが「・・回復の兆しが見られない長期の外見異常等の理由により、生存することが困難と容易に判断できる時点」とされていますが、「生存することが困難と容易に判断できる時点」に至る前にエンドポイントを設け、動物が著しい苦痛に曝されるのを防ぐべきではないでしょうか?その際、食欲不振が何日以上、体重減少が何%以上などの客観的指標を設けた上で、条件が当てはまるかどうかを定期的に観察、測定する具体的プランを記載させるべきではないでしょうか?
○質問3
平成24年度 承認番号12036 研究課題名 光―超音波イメージング法の開発 について
3-1 実験方法があまりにも大雑把すぎて、実験の全体像、動物への処置や時系列が不明です。後に「メールでの質問と回答」で一部答えてはいますが(それでもなお、不完全ですが)、最初から記載させるべきではないでしょうか?
3-2 実験の目的が「動物モデルを対象としたデータを取得する」となっていますが、何のデータを取得して、それにどんな意義があるのでしょうか?また、最初から記載させるべきではないでしょうか?
3-3 実験概要に「計測する」とありますが、何を計測し、それにより、何が得られるのでしょうか?
3-4 実験概要に「鼠径部、腹部を切開し」とありますが、どの程度切開するのでしょうか?また、最初から記載させるべきではないでしょうか?
3-5 実験群と対照群を設けるようですが、条件の違いは何なのでしょうか?また、最初から記載させるべきではないでしょうか?
3-6 ペントバルビタールには鎮痛作用がなく、また、意識喪失の状態が得られる用量が致死量に近いため、麻酔薬としての単独使用は現在は推奨されていません。他の薬剤を用いるべきではないでしょうか?
3-7 麻酔下の処置で覚醒させずに安楽死させる実験で苦痛カテゴリーBのようですが、なぜ人道的エンドポイントを設定されたのでしょうか?苦痛カテゴリーか人道的エンドポイントのどちらかが間違っているのではないでしょうか?(予期せぬ事故等への対処であれば別途規定等を設けるべきだと思います。)
○質問4
平成24年度 承認番号12037 研究課題名 光を用いた膵β細胞からのインスリン分泌促進 について
4-1 実験方法があまりに簡単すぎて、動物への処置も時系列も最初の計画書ではほとんど不明です。後に「メールでの質問と回答」で一部答えていますが、最初から詳細を書かせるべきではないでしょうか?
4-2 糖尿病モデルマウスは本実験で作製するのでしょうか?それともどこかから入手するのでしょうか?前者なら作製方法についてご教示ください。後者なら、どこから(どのように)入手するのかご教示ください。また、最初から記載させるべきではないでしょうか?
4-3 「経時的に青色光を照射して」とありますが、具体的な頻度や回数、時間間隔等の条件についてご教示ください。また、最初から記載させるべきではないでしょうか?
4-4 実験群と対照群の条件詳細についてご教示ください。また、最初から記載させるべきではないでしょうか?
4-5 動物の最大生存(観察)期間(実験上のエンドポイント、安楽死の時期)についてご教示ください。また、最初から記載させるべきではないでしょうか?
4-6 動物の予測される症状(有害事象)とその対処法について記載させるべきではないでしょうか?
4-7 移植する膵β細胞の量についてご教示ください。また、最初から記載させるべきではないでしょうか?
4-8 実験群78匹、対照群72匹のそれぞれの内訳、算出根拠についてご教示ください。また、最初から記載させるべきではないでしょうか?
4-9 ペントバルビタールには鎮痛作用がなく、また、意識喪失の状態が得られる用量が致死量に近いため、麻酔薬としての単独使用は現在は推奨されていません。他の薬剤を用いるべきではないでしょうか?
○質問5
平成22年度 承認番号11004 研究課題名 災害時に発生する出血性ショック心およびクラッシュ症候群に対する人口酸素運搬体を用いた救急救命治療 について
5-1 全体的に、動物への具体的な処置の記載がありません。また、実験全体の時系列やどんな群を設けるのかも不明瞭です。動物モデルの作成、その後の計測・評価を含め、動物への処置、動物に加える侵襲の観点から各群の詳細もわかるように全体を時系列でご説明いただけますでしょうか?また、最初からそのように記載させるべきではないでしょうか?
5-2 「使用動物数の算出根拠」が「実験の規模と実験回数から算出」として計40~80匹とされていますが、各実験ごと、各群ごとの内訳についてご教示ください。また、最初から記載させるべきではないでしょうか?
5-3 「治療群」や「蘇生群」の言葉が出てきますが、いくつの、どんな治療群や蘇生群を設けるのかわかりませんのでご教示ください。また、対照群は置くのでしょうか?また、最初から記載させるべきではないでしょうか?
5-4 投与物質の種類、量、投与経路、回数等についてご教示ください。また、最初から記載させるべきではないでしょうか?
5-5 動物に対する全ての処置が麻酔下の処置(覚醒させずに安楽死)でしょうか?全てが麻酔下の処置だとすると、カテゴリーD=重度の苦痛はどの場面で生じるのでしょうか?麻酔から覚醒する場合があることを想定しているということでしょうか?蘇生群は麻酔から覚醒させるのでしょうか?また、最初から記載させるべきではないでしょうか?
5-6 「苦痛の軽減、排除の方法」に記載されている「動物の疼痛は極めて少なく」とカテゴリーDの選択は矛盾しているのではないでしょうか?どちらが正しいのでしょうか?
5-7 動物の予測される症状(有害事象)とその対処法を記載させるべきではないでしょうか?
5-8 人道的エンドポイントの記載について、「障害作成後に病態が著しく悪化した個体、意識の回復があって苦痛を訴えた個体に限って・・・苦痛を除去する方向で検討する。」とありますが、「著しく悪化」や「苦痛を訴え」ていることをどのように判断するのでしょうか?また、「苦痛を除去する」というのは、安楽死以外の選択肢もあるということでしょうか?「・・する方向で検討」というのは、苦痛を除去しない場合もあるということでしょうか?その判断はどのように行うのでしょうか?また、最初から記載させるべきではないでしょうか?
○質問6
平成23年度 承認番号11017 研究課題名 キトサンの止血効果について について
6-1 大腿動静脈の切断はどの程度の切断でしょうか?また、最初から記載させるべきではないでしょうか?
6-2 止血完了後7日間データを取得し、その後、安楽死させるとなっていますが、7日目以降も飼育(観察)を行うことがあるのでしょうか?動物の最大生存(観察)期間(実験上のエンドポイント、安楽死の時期)を明確に記載させるべきではないでしょうか?
6-3 「使用動物数の算出根拠」で、「条件の異なる6種類のキトサンを用いた止血群」とありますが、「条件の異なる」とは具体的にどう条件が異なるのでしょうか?また、最初から記載させるべきではないでしょうか?
6-4 「使用動物数の算出根拠」で、コントロール群と止血させない群の違いは何でしょうか?また、止血させない群はそのまま出血死する可能性はないのでしょうか?
6-5 人道的エンドポイントの記載で、「苦痛等が観察されたら安楽死」とありますが、動物の苦痛をどのように判定するのでしょうか?また、そのための観察方法、プランはどうするのでしょうか?また、最初から記載させるべきではないでしょうか?
6-6 キトサンや麻酔薬の投与量や投与回数などについてご教示ください。また、最初から記載させるべきではないでしょうか?
6-7 大腿動静脈切断の止血方法、動物の予測される症状(有害事象)とその対処法など、後に委員会への質問に回答されていますが、最初から記載させるべきではないでしょうか?
6-8 ネンブタール(ペントバルビタール)には鎮痛作用がなく、また、意識喪失の状態が得られる用量が致死量に近いため、麻酔薬としての単独使用は現在は推奨されていません。他の薬剤を用いるべきではないでしょうか?
6-9 エーテルは動物に対して気道刺激性が強く、引火性や爆発性もあることから、動物福祉上、安全管理上、麻酔薬としても安楽死薬としても現在は推奨されていません。他の薬剤を用いるべきではないでしょうか?
○質問7
平成24年度 承認番号12019 研究課題名 脂肪組織及び骨髄由来の細胞を用いた再生医療のための基礎的検討 について
7-1 「放射線を照射したマウス」とは具体的にどんな条件のマウスなのでしょうか?本実験で照射するのでしょうか?(「放射線実験」に印がついていません。)どこかから入手するのでしょうか?本実験で照射するなら物理的条件をご教示ください。また、最初から記載させるべきではないでしょうか?
7-2 マウスへの各種細胞の移植の詳細(移植箇所、細胞の量など)についてご教示ください。また、最初から記載させるべきではないでしょうか?
7-3 各種細胞移植の「各種細胞」の内訳を細胞の種類、使用動物数を含めてご教示ください。また、最初から記載させるべきではないでしょうか?
7-4 in vivoイメージング装置で何を観察するのでしょうか?また、それにどのような意義があるのでしょうか?また、最初から記載させるべきではないでしょうか?
7-5 移植した細胞の形質変化を検討することにより何が得られ、どんな意義があるのでしょうか?また、最初から記載させるべきではないでしょうか?
7-6 動物の最大生存(観察)期間(実験上のエンドポイント、安楽死の時期)についてご教示ください。また、最初から記載させるべきではないでしょうか?
7-7 動物の予測される症状(有害事象)とその対処法を記載させるべきではないでしょうか?
7-8 細胞移植レシピエントとしてマウスが40匹必要になる理由についてご教示ください。
7-9 人道的エンドポイントに「苦痛等が観察されたら安楽死させ・・」とありますが、動物の苦痛をどのように判定するのでしょうか?また、そのための観察方法、プランはどうするのでしょうか?また、最初から記載させるべきではないでしょうか?
7-10 ネンブタール(ペントバルビタール)には鎮痛作用がなく、また、意識喪失の状態が得られる用量が致死量に近いため、麻酔薬としての単独使用は現在は推奨されていません。他の薬剤を用いるべきではないでしょうか?
7-11 エーテルは動物に対して気道刺激性が強く、引火性や爆発性もあることから、動物福祉上、安全管理上、麻酔薬としても安楽死薬としても現在は推奨されていません。他の薬剤を用いるべきではないでしょうか?
○質問8
平成24年度 承認番号12090 研究課題名 キトサンの止血効果と安全性について について
8-1 平成23年度の承認番号11017(質問6)の実験とほぼ同じ内容に見えますが、重複実験ではないのでしょうか?本実験にどんな新しい意義があるのでしょうか?
8-2 人道的エンドポイントには、「施術後、動物の食事摂取困難、苦痛等が観察されたら安楽死させ実験を中止する。」となっています。委員会の質問③への回答で、「自慰行為等により体調が悪化した場合」や、傷口が「自慰行為により開いた場合」は動物に苦痛がある状態と考えられますので、この場合に安楽死処置を行わないことは人道的エンドポイントの条件と矛盾していると思います。人道的エンドポイントを適切に設定するか、あくまで苦痛が観察されたら即時安楽死させるか、どちらかにすべきと思われますが、如何でしょうか?
8-3 委員会の質問③に対して、「SDラットは予想外に丈夫」という主観的理由や「過去に・・観察されたことは全くありません。」という過去の経験のみを理由にして人道的エンドポイントの設定をおろそかにしてよいことにはならないと考えますが、如何でしょうか?
(他は重複により省略)
○質問9
平成23年度 承認番号11041 研究課題名 外科侵襲時の生体反応解析とその修飾による予後の改善 について
9-1 「外科侵襲患者の予後の改善」を目的としていながら、細菌投与による肺炎モデルや敗血症モデルで実験を行う必然性が理解できません。ご説明いただけますでしょうか?
9-2 外科侵襲時の予後改善効果を調べるために動物の死をエンドポイントにする必然性が理解できません。委員会による質問と回答では、以前の実験で個体の生死をパラメータにした(のでその結果と比較検討する)ためと説明されており、個体の生死をパラメータとする必然性が説明されていませんが、前の実験のエンドポイントに必然性がなければ、前の実験の仕方が間違っているのであって、前の実験に合わせるために動物の死をエンドポイントにするのは本末転倒です。人道的エンドポイントの記載では、「重症患者の治療の最大目標は救命であり・・」ともありますが、ヒトと動物では種差がある上、死に至るまでには複雑な条件・パラメータが重なるため、生存率を見たり生存観察を行うことに科学的な意義が大きいとは思えません。本来、動物の死をはじめからエンドポイントに設定する実験は行われるべきではなく、よほどの必然性がなければならないはずです。審査の改善を求めます。
9-3 委員会の質問④への回答に関して、体温低下が起こらずに死亡する例があるからといって、体温低下が感染実験における死の指標の1つであるからには、それを人道的エンドポイントの条件に設定しない理由にはならないと思いますが、如何でしょうか?
9-4 実験全体の時系列や動物への具体的処置が不明です。動物への処置の観点からそれぞれの群の説明を含めて時系列でご説明いただけますでしょうか?また、最初からそのように記載させるべきではないでしょうか?
9-5 各種実験モデル作成法の詳細について、後に「メールでの質問」に回答されていますが、最初から記載させるべきではないでしょうか?
9-6 どの処置とどの処置で麻酔を使うのかについて、後に「メールでの質問」への答えの中で記載されていますが、最初から明確に書かせるべきではないでしょうか?
9-7 動物へ投与する薬剤や細菌の量について、後に「メールでの質問」への答えの中で記載されていますが、最初から書かせるべきではないでしょうか?
9-8 「使用動物数の算出根拠」で酪酸添加濃度の異なる投与群3群について、それぞれの濃度についてご教示ください。また、最初から記載させるべきではないでしょうか?
9-9 栄養管理モデルの実験について、動物の最大生存(観察)期間(実験上のエンドポイント)についてご教示ください。また、最初から記載させるべきではないでしょうか?
9-10 動物の予測される症状(有害事象)とその対処法を記載させるべきではないでしょうか?
?
○質問10
平成24年度 承認番号12021 研究課題名 細胞増殖因子ファミリー??の神経系における機能の解析 について
10-1 全体に何を行う実験なのかほとんどわかりません。動物への処置の観点からそれぞれの実験、群、条件ごとに時系列で詳細をご説明いただけますでしょうか?また、最初からそのように記載させるべきではないでしょうか?
10-2 「使用動物数の算出根拠」でマウス、ラットを神経系組織の初代培養及びスライスカルチャーに50頭使用するとありますが、マウス、ラットの使用頭数の内訳はどうなっていますでしょうか?また、最初から記載させるべきではないでしょうか?
10-3 「使用動物数の算出根拠」で「遺伝子組換えマウスの系統維持及び表現系の解析に50頭」とありますが、系統維持と表現系の解析の使用頭数の内訳をご教示ください。また、最初から記載させるべきではないでしょうか?なお、「表現系」ではなく、「表現型」ではないでしょうか?
10-4 トランスジェニックマウスと精神疾患モデルマウスのかけ合わせの詳細について記載がありませんので、ご教示ください。
10-5 「増殖因子の神経系細胞の生存、行動等に対する機能」の解析方法について詳細をご教示ください。また、最初から記載させるべきではないでしょうか?
10-6 表現型の解析方法と取得データの種類についてご教示ください。また、最初から記載させるべきではないでしょうか?
10-7 動物の最大生存(観察)期間(実験上のエンドポイント)についてご教示ください。また、最初から記載させるべきではないでしょうか?
10-8 動物の予測される症状(有害事象)とその対処法を記載させるべきではないでしょうか?
10-9 使用する麻酔薬の名称も量も記載されていませんが、どうなっているのでしょうか?
10-10 「組織を得るのに使用する動物は、麻酔薬等で意識を失わせ、」とあり、安楽死させるとの記載にはなっていませんが、組織採取後の動物は麻酔から覚醒させるのでしょうか?そうだとすれば、その理由と観察期間はどうなっていますでしょうか?
10-11 「苦痛を感じない状態で安楽死させる。」とありますが、実験終了後の処置では断首が選択されています。断首は「苦痛を感じない状態」なのでしょうか?また、通常、断首は軽麻酔下等で行うものだと思いますが、「実験終了後の処置」には記載されていません。麻酔薬は使用されないのでしょうか?また、安楽死法に断首を選択される理由は何でしょうか?
○質問11
平成23年度 承認番号11100 研究課題名 自己免疫性ぶどう膜炎モデルマウスの作出と解析について
11-1 抗原物質の種類と投与量について、後に「メールでの質問・回答」に記載があるものの、最初から記載させるべきではないでしょうか?
11-2 患眼に投与する薬剤名と量・投与期間について、後に「メールでの質問・回答」に記載があるものの、最初から記載させるべきではないでしょうか?なお、頻度や投与間隔、回数等も記載させるべきではないでしょうか?
11-3 動物を安楽死させるまでの期間について、後に「メールでの質問・回答」に記載があるものの、最初から記載させるべきではないでしょうか?
11-4 「実験方法」の(1)、(2)、(3)は、(1)、(3)、(2)の順番ではないのでしょうか?
11-5 「実験方法」(2)では「眼球を深麻酔下で摘出」となっていますが、この時点で安楽死はさせないのでしょうか?させないとすれば、理由は何でしょうか?(眼球摘出後の動物を何に使用するのでしょうか?)
11-6 「実験方法」(3)の「治療効果の検討」は具体的にどんな方法(観察や測定、評価の方法)で検討を行うのでしょうか?また、最初から記載させるべきではないでしょうか?
11-7 「実験方法」(2)で「組織病理学的検討」とは具体的に何を見るのでしょうか?また、最初から記載させるべきではないでしょうか?
11-8 実験の目的で、「治療法の研究」だけでなく、「病態解明」が挙げられていますが、薬剤非投与群を設ける必要はないのでしょうか?(「使用動物数の算出根拠」には記載されていません。)必要ないとすれば、非投与群と比較せずにどうやって病態解明を行うのでしょうか?
11-9 「使用動物数の算出根拠」に「1回の免疫で10匹程度を用いる。」とありますが、ここで言う「1回の免疫」とはどういう意味でしょうか?同じ動物を用いて免疫を3回行うなら、使用頭数は30匹ではなく10匹になるはずです。
11-10 ペントバルビタールには鎮痛作用がなく、また、意識喪失の状態が得られる用量が致死量に近いため、麻酔薬としての単独使用は現在は推奨されていません。他の薬剤を用いるべきではないでしょうか?
○質問12
平成25年度 承認番号13004 研究課題名 出血性ショック蘇生に対する低体温とradical scavengerの相乗効果について について(平成25年度 承認番号13085、平成23年度 承認番号11010も同様
12-1 人道的エンドポイントの記載で、「麻酔覚醒後、実験動物は苦痛なく、水分や餌の摂取できる。」とありますが、麻酔覚醒後に苦痛がないのであれば、なぜ苦痛カテゴリーがDなのでしょうか?「重症出血性ショックモデル」作成後に苦痛がないというのは考えづらいのですが。
(他省略)
○質問13
平成25年度 承認番号13042 研究課題名 外傷時の易出血性病態における人工血小板の適応2 について
13-1 「使用動物数の算出根拠」に「各モデルを10匹(コントロール5匹)とし、3モデル」とありますが、なぜ合計40匹なのでしょうか?10×3+5=35匹ではないのでしょうか?
13-2 「実験の分類」で感染実験と放射線実験に印がついていますが、何の感染を行うのでしょうか?また、どの場面で放射線を使用するのでしょうか?
13-3 どこからどこまでの処置が麻酔下の処置でしょうか?また、最初から記載させるべきではないでしょうか?
13-4 実験概要からは動物を麻酔から覚醒させるのかさせないのか、覚醒後の観察(生存)期間が不明です。後にメールでの質問に回答されていますが、最初から記載させるべきではないでしょうか?
13-5 動物の予測される症状(有害事象)とその対処法を記載させるべきではないでしょうか?
13-6 ネンブタール(ペントバルビタール)には鎮痛作用がなく、また、意識喪失の状態が得られる用量が致死量に近いため、麻酔薬としての単独使用は現在は推奨されていません。他の薬剤を用いるべきではないでしょうか?
13-7 救命率を見る科学的意義と必然性についてご教示ください。また、最初から記載させるべきではないでしょうか?また、本来、動物福祉の観点から、動物の死をエンドポイントにする、救命率を見るような実験は行うべきではなく、別のものを実験結果の指標とすべきと思いますが、如何でしょうか?
13-8 動物の死がエンドポイントになる可能性があるのであれば、人道的エンドポイントの「死に至る兆候や様子」について客観的指標を定め、条件への合致を遅滞なく判定できるように、具体的な動物観察の条件(頻度や方法、責任者など)や観察プランを記載させるべきではないでしょうか?
13-9 人道的エンドポイントが一応設定されているようですが、条件に合致した際の安楽死は救命率において「死」とカウントするという理解でよろしいでしょうか?また、最初から記載させるべきではないでしょうか?
○質問14
平成25年度 承認番号13027 研究課題名 皮膚創傷治癒に関する研究 について(平成24年度 承認番号12051も同様)
14-1 形態学的観察とは何を観察するのでしょうか?
14-2 本実験でどんな新規の知見を得られる可能性があるのでしょうか?
14-3 文献や過去の研究例で代替できないのでしょうか?
14-4 皮膚欠損創および切開縫合創の詳細についてご教示ください。また、最初から記載させるべきではないでしょうか?
14-5 「経時的に創部より組織を採取」の経時的について、時間間隔や回数、期間等をご教示ください。また、この処置は麻酔下なのでしょうか?また、最初から記載させるべきではないでしょうか?
○質問15
平成24年度 承認番号12092 研究課題名 好中球増加・リンパ球減少が腫瘍免疫へ与える影響についての研究 について
15-1 動物への処置の時系列、各段階の実験、実験群の詳細、物質の投与量等、後に委員会の質問への回答の中で一部明らかにされていますが、最初の計画書には全く記載されていません。これほどの内容の実験をたった3行で説明できるはずがありません。このようなことがないように厳しく指導すべきと思いますが如何でしょうか?
15-2 実験の目的が「NLR上昇が腫瘍免疫にどのように関与しているかについて検討する。」であるにも関わらず、その評価指標に動物の死を充てる必然性はあるのでしょうか?あるとすれば、科学的妥当性についてご教示ください。動物の死は必ずしも科学的な指標になるとは思えず、他の指標を用いるべきだと考えます。
15-3 「生存時間の差を観察する」すなわち動物の死をエンドポイントにする実験を行うにも関わらず、最初の計画書には「生命予後の差をみる。」とだけしか書かれておらず、人道的エンドポイントの説明の方には「モデル作成後2-3週間後に犠死させ実験が終了する。」とあり、動物の死をエンドポイントにする実験については触れられていません。委員会の質問により各実験内容の詳細がある程度明らかになったものの、「生命予後の差を見る」などの曖昧な表現では見過ごされてしまう可能性がありますし、人道的エンドポイントの記載のように紛らわしい記載は止めさせるべきです。委員会の審査を通るために意図的にこのような記載をしているとすれば問題です。このようなことがないように厳しく指導すべきだと思いますが、如何でしょうか?
15-4 上記のような見過ごしをなくすために、動物の最大生存(観察)期間(実験上のエンドポイント、安楽死の時期)は各実験ごと、各群ごとに毎回必ず明確に書かせるべきと考えますが、如何でしょうか?
15-5 差し替え後の計画書の実験2(colon26細胞の腹腔内投与がマウス生体に与える影響について)において、動物の最大生存(観察)期間が記されていませんのでご教示ください。(「概ね20日程度生存可能な注入量を決定する。」とありますが、20日を過ぎたらどうするのか?安楽死させるのか、それとも動物が死ぬまで観察を続けるのか?)また、最初から記載させるべきではないでしょうか?
15-6 差し替え後の計画書の実験2(colon26細胞の腹腔内投与がマウス生体に与える影響について)において、「概ね20日程度生存可能な注入量を決定する。」とありますが、これはぎりぎり20日程度生存可能な量すなわち動物が致死する可能性のある投与量を設定しているということでしょうか?そうであるとすれば、その点を明確に記載させるべきではないでしょうか?
15-7 差し替え後の計画書の記載で、実験2(colon26細胞の腹腔内投与がマウス生体に与える影響について)と実験4(G-CSF投与が腹膜播種モデルの生存時間に及ぼす影響について)が動物の死をエンドポイントとしているようですが、この際、人道的エンドポイントを適用するかどうかが明確に記載されていません。明確に記載させるべきではないでしょうか?
○質問16
平成23年度 承認番号11007 研究課題名 外科手術の基本学習 について(平成23年度 承認番号11028も同様)
16-1 外科処置後に動物を覚醒させるのかさせないのか、安楽死のタイミング、また、外科手技の詳細が不明です。記載させるべきではないでしょうか?
○質問17
平成24年度 承認番号12002 研究課題名 組織特異的な遺伝子導入 について
17-1 各種実験の内容や各群の詳細、動物への処置の詳細、時系列などが全く不明です。それらがわかるようにご説明いただけますでしょうか?また、最初から記載させるべきではないでしょうか?
17-2 実験概要と「使用動物数の算出根拠」の対応関係が不明です。遺伝子導入条件の決定と疾患モデルマウス作製にそれぞれ何匹使用されるのでしょうか?「2観察期間」とは何のことでしょうか?対照群とは何に対する対照でしょうか?17-1に含めてご説明いただけますでしょうか?
17-3 実験目的と実験概要が「疾患モデル動物を作製する。」で終わっていますが、作製することによって何が得られるのでしょうか?疾患モデルを作製後、何を観察するのでしょうか?
17-4 疾患モデル作成後の動物はいつ、何が終了したら安楽死になるのでしょうか?
17-5 どの処置に麻酔薬を使用されるのか、またその投与量をご教示ください。また、最初から記載させるべきではないでしょうか?
17-6 それぞれの遺伝子の投与量や回数、頻度等の条件をご教示ください。また、最初から記載させるべきではないでしょうか?
17-7 人道的エンドポイントの記載で「実験動物に対する苦痛は著しく低いものと考えられる」とありますが、苦痛カテゴリーDが選択されており、明らかに矛盾しています。どちらが正しいのでしょうか?苦痛カテゴリーが正しいとすれば、動物の苦痛はどの場面で発生すると考えられるでしょうか?
○質問18
平成24年度 承認番号12080 研究課題名 重症感染症に対するエンドトキシン吸着療法が免疫機能に与える影響に関する基礎研究 について
18-1 LPS血症モデル作成~体外血液循環~採血~安楽死の一連の流れの中で、ラットを麻酔から覚醒させる、あるいは麻酔の効果が切れると思われる時間帯はあるのでしょうか?あるとすればどの時点でしょうか?
18-2 「メールでの質問と回答」で、申請者は「体外血液循環時のネンブタール麻酔で2時間持続させることは可能でしょうか。」との質問に対し、「ネンブタールのみによる麻酔では、2時間は難しいと考えていますが、当初30分での測定を行います。」と回答していますが、30分以上行うことはあったのでしょうか?そうだとすれば、麻酔の維持はどうされたのでしょうか?
18-3 委員の質問に対する回答①で申請者は、「イソフルレン麻酔であれば、麻酔深度を一定にして長時間持続可能と思いますが、この点は考慮されたのでしょうか。」との質問に対し、「技術習得まで、必要以上の時間と動物が必要になるので、積極的には検討しておりませんが、必要であれば検討したいと考えております。」と回答していますが、結局麻酔はネンブタールにしたのでしょうか、イソフルレンにしたのでしょうか?また、自分に技術がないのであれば、技術がある人の助けを借りて行えばよいのではないでしょうか?長時間の手技の麻酔維持を、自分に技術がないから不安定な方法で行うというのは本末転倒だと思います。
18-4 麻酔薬について、LPS血症モデル作成にはケタミンを、体外血液循環にはネンブタールを用いる理由についてご教示ください。また、「苦痛の軽減、排除の方法」にはネンブタールしか記載されていませんが、どうなっているのでしょうか?
18-5 実験の目的が「重症感染症に対するエンドトキシン吸着療法前後の免疫機能の変化を解明する」となっていますが、LPS血症モデルとエンドトキシン吸着療法を用いた実験結果が全ての重症感染症に適用できるのでしょうか?
18-6 委員の質問に対する回答④で申請者は、予備実験を実施することで動物数を削減できないか、との質問に対し、「可能かもしれませんが、どこまで削減できるかは明示できません。」と回答していますが、結局予備実験は行ったのでしょうか?また、動物数は削減できたのでしょうか?
18-7 使用動物数の算出根拠が「ラットを用いた体外循環実験は報告が極めて少ないこと、比較検討に要する動物数として100匹」とされていますが、これが算出根拠と言えるのでしょうか?ip群、iv群、対照群などの内訳はどうなっているのでしょうか?あまりに大雑把であり、いい加減な記載だと思います。「報告が極めて少ない」実験なら、予備実験で動物数を減らすのは必須ではないでしょうか?
18-8 人道的エンドポイントの条件で、「運動量の低下や摂食・摂水量の低下など、全身状態の衰弱」を挙げていますが、食欲不振が何日以上、体重減少が何%以上などの客観的指標を設けた上で、条件が当てはまるかどうかを定期的に観察、測定する具体的プランを記載させるべきではないでしょうか?
18-9 動物の予測される症状(有害事象)とその対処法を記載させるべきではないでしょうか?
18-10 ネンブタール(ペントバルビタール)には鎮痛作用がなく、また、意識喪失の状態が得られる用量が致死量に近いため、麻酔薬としての単独使用は現在は推奨されていません。他の薬剤を用いるべきではないでしょうか?
○質問19
平成25年度 承認番号13012 研究課題名 周術期炎症反応による免疫抑制の腫瘍増殖への関与に関する研究 について
19-1 実験全体の時系列が不明瞭です。動物への処置の観点から各方法(実験)ごと、各群ごとに時系列で説明していただけますでしょうか?また、最初からそのように記載させるべきではないでしょうか?
19-2 開腹群は手術の侵襲を作り出す意味という理解で合ってますでしょうか?どの箇所をどのようにどの程度開腹するのでしょうか?また、最初から記載させるべきではないでしょうか?
19-3 方法1で①の開腹群と②の開腹のみの群はどう違うのでしょうか?違わないとすれば、両方の群を設ける意義はどこにあるのでしょうか?
19-4 方法1、2で、「樹状細胞の移入」はどの時期に行うのでしょうか?また、どの群に対して何匹使用して行うのでしょうか?また、最初から記載させるべきではないでしょうか?
19-5 方法1の①、②で「2週間後に犠死させ」とあり、③で「それぞれの群間で生命予後の差をみる。」となっていますが、これは最大2週間以内の範囲で「生命予後の差をみる。」という理解でよいでしょうか?
19-6 方法2でControl群と非開腹群の違いは何なのでしょうか?
19-7 メールでの質問③で、「「生命予後の差を見る」とありますが、死ぬまで待つことはできません、人道的エンドポイントを決めて下さい。」との指摘に対し、申請者は人道的エンドポイントの条件を答えていますが、計画書の「生命予後の差を見る」の記載はそのままになっています。これは、人道的エンドポイントの条件に合致した際の安楽死は「死」として扱うという理解でよいでしょうか?また、計画書に明確に記載させるべきではないでしょうか?
19-8 メールでの質問と回答③では、人道的エンドポイントによる安楽死について「頸椎脱臼をもって」と書かれていますが、人道的エンドポイントの記載や「実験終了後の処置」ではネンブタールによる深麻酔と記載されています。どちらが正しいのでしょうか?
19-9 後に「メールでの質問と回答」で回答されていますが、当初の計画書には、動物モデル作成方法詳細の説明、どこからどこまでが麻酔下の処置か、動物の予測される症状とその対処法など基本的な事項の記載がありません。最初から記載させるべきではないでしょうか?
19-10 「盲腸結紮穿刺法」のように、動物実験委員にも分からない用語を何の説明もなく用いるのは問題ではないでしょうか?
19-11 動物の死がエンドポイントになる可能性があるのであれば、人道的エンドポイントの条件への合致を遅滞なく判定できるように、条件が当てはまるかどうかを定期的に観察、測定する具体的プランを記載させるべきではないでしょうか?
19-12 本来、動物福祉の観点から、動物の死をエンドポイントにする、「生命予後の差」を実験結果の指標とするような実験は行うべきではなく、別のものを実験結果の指標とすべきと思いますが、如何でしょうか?
19-13 ネンブタール(ペントバルビタール)には鎮痛作用がなく、また、意識喪失の状態が得られる用量が致死量に近いため、麻酔薬としての単独使用は現在は推奨されていません。他の薬剤を用いるべきではないでしょうか?
○質問20
平成24年度 承認番号12058 研究課題名 新たなマウス腹腔内癒着モデルの確立とナノシートを用いた癒着防止効果の検討 について(平成24年度 承認番号120591も同様)
20-1 新たな腸管癒着モデル作成が実験目的の1つとなっていますが、その意義について説明がありませんので、ご教示ください。また、最初から記載させるべきではないでしょうか?
20-2 後に質問と回答である程度明らかになるものの、当初の計画書では実験の時系列、動物モデルの作成方法、ナノシート等の貼付方法等が全く不明です。新たな動物モデルを作成するにも関わらず、作成方法の詳細を説明しないというのは問題ではないでしょうか?また、ナノシートの癒着防止剤としての効果を検討するのが実験目的であるにも関わらず、ナノシートの使用方法の詳細を説明しないというのは問題ではないでしょうか?
20-3 ナノシートは市販品なのでしょうか、オリジナル作製品なのでしょうか?また、後に市販品と説明されていますが、「セプラフィルム」や「インターシード」の説明も最初から記載させるべきではないでしょうか?
20-4 動物の最大生存(観察)期間(実験上のエンドポイント、安楽死の時期)についてご教示ください。また、最初から記載させるべきではないでしょうか?
20-5 人道的エンドポイントの記載で開腹創の疼痛への対処が記載されていますが、癒着モデル作製に起因する疼痛への対処はどうするのでしょうか?また、最初から記載させるべきではないでしょうか?
20-6 ネンブタール(ペントバルビタール)には鎮痛作用がなく、また、意識喪失の状態が得られる用量が致死量に近いため、麻酔薬としての単独使用は現在は推奨されていません。他の薬剤を用いるべきではないでしょうか?
20-7 安楽死について、ネンブタールによる深麻酔と断首を状況に応じて選択する理由についてご教示ください。また、計画書の「実験終了後の処置」が選択されていませんが、どうなっているのでしょうか?
○質問21
平成24年度 承認番号12093 研究課題名 肝組織における機能およびバイアビリティ―の光学的診断に関する研究 について
21-1 (後に委員会等の質問で回答しているものの、)「実験概要」では、低酸素モデルという言葉だけが出てきて、その作製については全く触れられていません。実験方法の記載として甚だ不適切ではないでしょうか?(「メールでの質問と回答」⑤で、承認済み計画書で採用されているとの記載がありますが、そうだとしても、手続き上、重複してでも説明するか、少なくとも以前の計画書番号とともにその旨を計画書に記載すべきではないでしょうか?)虚血モデルについても作製方法の詳細が記載されていません。
21-2 「メールでの質問と回答」③で、虚血モデル作製法の詳細について問われていますが、回答では虚血の時間や計測法が書かれているのみで、肝心のモデル作製法が記載されていません。どうなっているのでしょうか?虚血モデル作製法の詳細についてご教示ください。
21-3 「メールでの質問と回答」で明らかになりますが、当初の計画書には計測時間や飼育期間が書かれていません。最初から記載させるべきではないでしょうか?
21-4 「使用動物数の算出根拠」で、「低酸素3条件」、「虚血の程度の異なる3条件」の記載がありますが、具体的条件の記載がありませんのでご教示ください。また、最初から記載させるべきではないでしょうか?
21-5 「使用動物数の算出根拠」に「再酸素化の検討」とありますが、実験概要に記載されていません。詳細についてご教示ください。また、最初から記載させるべきではないでしょうか?
21-6 本実験は、モデル作製~計測~安楽死の全ての過程において、麻酔下での処置と考えてよいでしょうか?もし麻酔から覚醒させる(させた)ことがあるとすれば、どの時点でしょうか?もし麻酔から覚醒させずに全ての処置を行う場合、苦痛のカテゴリー(D)や人道的エンドポイントの設定を修正すべきではないでしょうか?
21-7 「メールでの質問と回答」③(および委員会からの質問⑤)で申請者は、当初の計画を変更して、動物の経過観察期間を設けないこととした旨回答しています。そうであるならば、何故質問を受ける前に計画書を出し直さないのでしょうか?また、修正されたとみられる計画書にも、まだ「観察期間」についての記載が残っています。この部分は修正させるべきではないのでしょうか?
○質問22
平成25年度 承認番号13041 研究課題名 動物モデルを用いたPTSDの病態解明およいPTSDの予防と治療に関する研究 について
22-1 実験の時系列、各群の詳細が不明です。動物への処置の観点から各実験ごと、各群ごとに時系列で説明していただけますでしょうか?また、最初からそのように記載させるべきではないでしょうか?
22-2 実験概要の終わり部分の「PTSDと関係が深い脳部位に上記遺伝子に関連する薬剤や神経毒」を投与する実験はどの群に対して行う処置、あるいは新たな群なのでしょうか?
22-3 「PTSDと関係が深い脳部位に上記遺伝子に関連する薬剤や神経毒」を投与する実験が「使用動物数の算出根拠」に入っていませんが、どうなっているのでしょうか?
22-4 「PTSDと関係が深い脳部位に上記遺伝子に関連する薬剤や神経毒」を投与することによって何が得られる(と想定される)のでしょうか?また実際、何が得られたのでしょうか?
22-5 「PTSD類似行動の変化を観察する」とありますが、具体的に何を観察するのでしょうか?また、最初から記載させるべきではないでしょうか?
22-6 「使用動物数の算出根拠」では、「対照群に溶媒を投与する群、ストレス負荷群に溶媒を投与する群、ストレス負荷群に低用量の薬物を投与する群、負荷群に中等用量の薬物を投与する群、負荷群に高用量の薬物を投与する群」の5群(50匹)が必要とありますが、これらは「PTSDへの効果が期待される薬剤」1種類分あたりの使用動物数だと思います。しかしながら、委員会の質問①への回答によれば、平成25年度は3種類の薬剤(+その他の処置)を使用するとのことですから、2種類目以降の薬剤では溶媒投与群が省略されるとしても、合計180匹では足りない計算になってしまいます。どうなっているのでしょうか?
22-7 「使用動物数の算出根拠」では、PTSDへの効果が期待される薬剤の投与実験に5群(50匹)×2種類の薬剤=100匹、環境負荷処置や高頻度経頭蓋磁気刺激処置の実験に4群(40匹)×2処置=80匹で計180匹と説明されているにも関わらず、委員会の質問①への回答では、4~3群(50 or 40匹)×3種類の薬剤と環境負荷処置や高頻度経頭蓋磁気刺激処置の実験で合わせて180~200匹と説明されています。しかも「実験が承認されてからの時期では180匹の使用は現実的でないので、140匹に訂正してください。」などとされています。どちらが正しいのでしょうか?後者の説明(委員会への回答①)では、算出根拠が曖昧になっており、これでは当初の算出根拠はデタラメだったと思わされます。せっかく算出根拠を書かせても、結局は根拠に基づかない直観や感覚で使用頭数を決めるのであれば、計画書を書かせる意味がありません。3Rの厳守のためにも厳しく指導していただきたいと思います。
22-8 実験概要では「環境富化処置や電気けいれん処置・高頻度経頭蓋磁気刺激処置を施す」とされていますが、「使用動物数の算出根拠」では「電気けいれん処置」が入っていません。どうなっているのでしょうか?
22-9 実験群、対照群の説明が「使用動物数の算出根拠」で初めて出てきますが、これらは「実験概要」に記載させるべきではないでしょうか?(単に記載場所の問題ではなく、実験全体の流れで記述しないと、実験の全体像がわかりません。)
22-10 (後に「メールでの質問と回答」に記載されているものの、)投与する薬剤の名称、投与量、投与経路、投与期間などは毎回必ず最初から記載させるべきではないでしょうか?
22-11 「PTSDと関係が深い脳部位に上記遺伝子に関連する薬剤や神経毒」を投与する実験について、麻酔を使ったカニューレ挿入を伴う処置であるにも関わらず、当初の計画書には「局所投与して」としか書かれておらず、麻酔の使用についてもカニューレの使用についても全く記載されていません。計画書の記載方法として甚だ不適切ではないでしょうか?また、「苦痛の軽減、排除の方法」では麻酔薬記載の欄が空欄になっています。どういうことなのでしょうか?
22-12 (後に「メールでの質問と回答」に回答されているものの、)「環境富化処置」や「電気けいれん処置」、「高頻度経頭蓋磁気刺激処置」などの動物に対する処置の詳細について、当初の計画書には全く記載されていません。最初から記載させるべきではないでしょうか?
22-13 動物の最大生存(観察)期間(実験上のエンドポイント)が不明瞭です。全ての群において、IS(逃避不能ストレス)負荷後2週間で安楽死させるという理解でよいでしょうか?また、毎回明確に記載させるべきではないでしょうか?
22-14 動物の予測される症状(有害事象)とその対処法を記載させるべきではないでしょうか?
22-15 ネンブタール(ペントバルビタール)には鎮痛作用がなく、また、意識喪失の状態が得られる用量が致死量に近いため、麻酔薬としての単独使用は現在は推奨されていません。他の薬剤を用いるべきではないでしょうか?
○質問23
平成24年度 承認番号12048 研究課題名 第2学年 感染症系実習「トキソプラズマ」 について
23-1 実験の目的に、「本症の病態理解の向上を意図し・・・本症の病態、病因、病理への理解深化を目的とする。」とありますが、実験概要を見ると、トキソプラズマをマウスへ感染させ、安楽死させた後に原虫を回収して顕微鏡で供覧する、との実験内容になっています。この実験内容で、どうしてトキソプラズマ感染症の病態理解が向上し、本症の病態、病因、病理への理解深化につながるのかが理解できません。実験目的と実験内容との整合性について、合理的にご教示ください。本当に動物の苦痛顕現以前に動物を安楽死させるなら、恐らく「病態」は理解できないでしょうし、原虫を顕微鏡で見るだけなら、わざわざ動物へ感染させる必要はないでしょう。これだけの実験で病因や病理への理解深化につながるとも思えません。実験意義の再検討と動物を用いない方法の検討をお願いします。
23-2 「使用動物数の算出根拠」で「デモ用顕微鏡で供覧することから算出」として12匹使用の記載がありますが、意味がわかりませんので、ご説明ください。
23-3 「マウス体内での原虫増殖が認められた時点で、動物の苦痛顕現以前に動物を安楽死に処する。」とのことですが、原虫増殖をどのように確認するのでしょうか?また、最初から記載させるべきではないでしょうか?また、その方法で本当に動物の苦痛が顕現する前に増殖を確認できるのでしょうか?
23-4 どの処置に麻酔薬を使用し、動物を覚醒させるのかさせないのかが不明ですので、ご教示ください。また、最初から記載させるべきではないでしょうか?
23-5 麻酔薬について、実験概要では「エーテル等」、「苦痛の軽減、排除の方法」では「ソムノペンチル等」となっていますが、どちらが正しいのでしょうか?
23-6 エーテルもソムノペンチル(ペントバルビタール)も動物福祉上、または安全管理上、麻酔薬としての使用は不適切、あるいは推奨されないとされています。他の薬剤を用いるべきではないでしょうか?
○質問24
平成25年度 承認番号13009 研究課題名 麻酔薬による幼弱脳への毒性およびオキシトシンの与える影響について について
24-1 実験概要では「吸入麻酔薬無し群では暴露後ネンブタールを腹腔内投与し断首、吸入麻酔薬有り群では暴露直後に断首し」と書いてありますが、「メールでの質問と回答」では暴露後、安楽死の時期は1,3,7,14,21日後とされています。どちらが正しいのでしょうか?また、なぜ不一致が起きているのでしょうか?
24-2 上記で、もし「メールでの質問と回答」の方が正しいのであれば、(以下①~④)
①なぜ最初から記載しないのでしょうか?また、計画書の「暴露直後に断首」の部分は修正すべきではないでしょうか?
②「メールでの質問と回答」にある「暴露後に時間経過を必要とする場合」とはどういう場合を指すのでしょうか?
③暴露後、安楽死までの期間はなぜ設けられているのでしょうか?その間、何を観察するのでしょうか?
④安楽死までの時期を1,3,7,14,21日後とするのであれば、合計24の群との関係はどのようになるのでしょうか?群や使用匹数は増えないのでしょうか?
24-3 実験概要では「オキシトシン又はその拮抗薬であるアトシバンを腹腔内投与することで」とありますが、「メールでの質問と回答」では、オキシトシン、アトシバンの投与経路は「皮下注射、腹腔内投与、脳室内投与」とされています。どちらが正しいのでしょうか?また、なぜ不一致が起きているのでしょうか?
24-4 上記で、もし「メールでの質問と回答」の方が正しいのであれば、なぜ投与経路を3種類設ける必要があるのでしょうか?また、投与経路を変えることによって実験結果の比較に影響を与えないのでしょうか?もし投与経路ごとに別の群として設定するなら、使用匹数は増えないのでしょうか?
24-5 動物の予測される症状(有害事象)とその対処法を記載させるべきではないでしょうか?
24-6 後に「メールでの質問と回答」で回答されていますが、使用薬剤の投与量や投与経路は最初から記載させるべきではないでしょうか?
○質問25
平成24年度 承認番号12094 研究課題名 内耳障害に対する新しいタンパク治療 について(平成24年度 承認番号12095も同様)
25-1 実験概要の説明が大雑把すぎて、動物への処置の詳細、実験内容の詳細が不明です。動物への処置の観点から各群の詳細説明を含め、時系列で説明していただけますでしょうか?また、最初からそのように記載させるべきではないでしょうか?
25-2 強大音暴露や薬剤投与の詳細が記載されていません。内耳音響外傷モデルの作製方法詳細についてご教示ください。また、最初から記載させるべきではないでしょうか?
25-3 動物へ投与する物質、薬剤の種類、投与量、投与経路、投与期間、投与時期、回数等についてご教示ください。また、最初から記載させるべきではないでしょうか?
25-4 「それぞれの群において機能的(聴覚)、組織学的な検討を行う。」とされていますが、「機能的(聴覚)、組織学的な検討」の詳細についてご教示ください。また、最初から記載させるべきではないでしょうか?
25-5 ABR測定の詳細について全く記載されていません。動物への処置の観点からご教示ください。また、最初から記載させるべきではないでしょうか?
25-6 動物の最大生存(観察)期間(実験上のエンドポイント、安楽死の時期)についてご教示ください。また、最初から記載させるべきではないでしょうか?
25-7 動物の予測される症状(有害事象)とその対処法を記載させるべきではないでしょうか?
25-8 人道的エンドポイントの記載で、「多大な苦痛を与えることはない」「特に苦痛はない」などとされていますが、全身麻酔下での暴露とはいえ、飼育期間中に内耳音響外傷に由来する苦痛は本当にないのでしょうか?また、その根拠は何でしょうか?
25-9 人道的エンドポイントの記載で、「人道的エンドポイントに十分注意して実験を行う」としながら、人道的エンドポイントの条件が記載されていません。人道的エンドポイントを設定するのでしょうか、しないのでしょうか?また、申請者は人道的エンドポイントを理解しているのでしょうか?
25-10 「使用動物数の算出根拠」に「いくつかの暴露条件の検討が必要であるため」と記載されていますが、「いくつかの暴露条件」とは具体的に何なのでしょうか?また、内耳音響外傷モデルの作製方法の違いによる内訳についてご教示ください。また、それらを確かめずに84匹もの動物の使用を認めるのは問題ではないでしょうか?
25-11 実験概要に「組織学的検討のための断頭」とありますが、「実験終了後の処置」には「ネンブタールによる安楽死」となっています。どうなっているのでしょうか?
○質問26
平成25年度 承認番号13088 研究課題名 内耳音響外傷メカニズムの解明および低出力レーザー照射による治療効果の検討 について
26-1 治療(LLLT)の実施時期が不明ですので、ご教示ください。また、最初から記載させるべきではないでしょうか?
26-2 音響負荷、治療(LLLT)、聴力評価(ABR)の詳細、物理的条件が記載されていません。ご教示ください。また、最初から記載させるべきではないでしょうか?
26-3 実験概要の「強大音負荷」には麻酔薬の使用が記載されておらず、人道的エンドポイントの記載でも、「本研究課題の動物実験では、麻酔下で実験(レーザー治療および聴力評価)を行う」とされており、「強大音負荷」が記載されていません。この処置に麻酔薬は使用されたのでしょうか?もしも「強大音負荷」(5時間)が麻酔下の処置でないとすれば、苦痛カテゴリーはCではないと思いますし、動物の苦痛への対処法や人道的エンドポイントを設定すべきと思われますが、如何でしょうか?
26-4 人道的エンドポイントの記載欄に記載されているのは、人道的エンドポイントとは関係ないことばかりで、人道的エンドポイントの条件が記載されていません。人道的エンドポイントの条件を設定するのかしないのかどちらなのでしょうか?設定しないのであれば、理由を記載させるべきではないでしょうか?申請者は人道的エンドポイントを理解しているのでしょうか?
26-5 実験概要の「治療」と「聴力評価」では「塩酸ケタミンおよび塩酸メデトミジンの腹腔内投与で鎮静を行う」と記載されていますが、麻酔を行うとは記載されていません。これは意識消失を伴わない用量という意味でしょうか?
26-6 「使用動物数の算出根拠」に治療群、無治療群の内訳が記載されていません。どうなっているのでしょうか?
26-7 「使用動物数の算出根拠」で、「過去の文献上、・・・十分な数と考えられる。」とのことですが、3Rの観点から、使用動物数は「十分」なだけではなく、「必要」な最低数でなければなりません。これだけの数が「必要」な根拠についてご教示ください。また、最初から記載させるべきではないでしょうか?
26-8 動物の予測される症状(有害事象)とその対処法を記載させるべきではないでしょうか?
○質問27
平成25年度 承認番号13078 研究課題名 頭頸部末梢神経障害に対するセンダイウイルスによる遺伝子治療の研究 について(平成25年度 承認番号13077も類似)
27-1 「使用動物数の算出根拠」に「5匹/群×4群×2実験」と記載されていますが、4群の内訳が不明ですので、ご教示ください。また、最初から記載させるべきではないでしょうか?
27-2 実験概要の「遺伝子導入効率の検討」で1,3,7,14,28日後にラットを安楽死させるとの記載がありますが、群との関係はどうなっているのでしょうか?また、最初から記載させるべきではないでしょうか?
27-3 「遺伝子導入効率の検討」、「治療遺伝子による神経障害改善効果の検討」それぞれにおいて、反回神経障害モデルラット、顔面神経障害モデルラットのどちらを何匹ずつ使うのかの記載がありませんが、どうなっているのでしょうか?また、群との関係はどうなっているのでしょうか?また、最初から記載させるべきではないでしょうか?
27-4 「遺伝子導入効率の検討」、「治療遺伝子による神経障害改善効果の検討」それぞれにおいて、注入する遺伝子が複数記載されていますが、複数の遺伝子を一度に投与するのでしょうか、それとも1種類ずつ投与するのでしょうか?後者だとすれば、どの遺伝子を何匹ずつに割り当てるのでしょうか?また、群との関係はどうなっているのでしょうか?また、最初から記載させるべきではないでしょうか?
27-5 上記3点を踏まえて、使用動物数は増えないのでしょうか?
27-6 反回神経障害モデルラット、顔面神経障害モデルラットの作成において、「鉗子にて1分間圧迫または神経を切断し」とありますが、どちらを採用するのでしょうか?また、最初から記載させるべきではないでしょうか?
27-7 実験概要の「治療遺伝子による神経障害改善効果の検討」で、「神経伝導速度を測定し」とありますが、神経伝導速度の測定方法の詳細を動物への処置の観点からご教示いただけますでしょうか?また、最初から記載させるべきではないでしょうか?
27-8 「メールでの質問と回答」で、神経障害モデルラットが恒常的な痛みを感じることはないか、との質問に対し、「恒常的な痛みはありません。」と回答されていますが、本当に恒常的な痛みはないと言えるのでしょうか?そうだとすれば、なぜそのように言えるのか、根拠をご教示ください。
27-9 神経障害モデルの作成は全身麻酔下で行うとされており、もしも恒常的な痛みもないとすれば、なぜ苦痛カテゴリーがDなのでしょうか?動物の苦痛はどの場面で発生するのでしょうか?
27-10 エンドポイントの記述で、「著明な体重減少などの全身状態悪化を認める場合には安楽死を検討する。」とされていますが、苦痛カテゴリーDなのであれば、食欲不振が何日以上、体重減少が何%以上などの客観的指標を設けた上で、条件が当てはまるかどうかを定期的に観察、測定する具体的プランを記載させるべきではないでしょうか?
27-11 ネンブタール(ペントバルビタール)には鎮痛作用がなく、また、意識喪失の状態が得られる用量が致死量に近いため、麻酔薬としての単独使用は現在は推奨されていません。他の薬剤を用いるべきではないでしょうか?
○質問28
平成25年度 承認番号13028 研究課題名 ラットにおけるセボフルランエマルション静脈内投与の検討 について(平成24年度 承認番号12078も同様)
28-1 麻酔効果の至適濃度を調べる実験(righting reflexの消失)の詳細について、動物への処置の観点からご説明いただけますでしょうか?また、最初から記載させるべきではないでしょうか?
28-2 「メールでの質問と回答」で麻酔薬の投与量について12段階の投与量を回答されていますが、至適濃度、致死濃度を調べる実験それぞれで使用するラット25匹ずつをどのように割り当てるのかご教示ください。1匹のラットに複数段階の用量を投与するのか否か、するとすれば麻酔から覚醒させるのかさせないのか、時間間隔をどうするのか、についてもご教示ください。また、最初から記載させるべきではないでしょうか?
28-3 実験概要で「セボフルランエマルションを尾静脈あるいは頸静脈から投与」とありますが、至適濃度、致死濃度を調べる実験それぞれについて、使用するラット25匹ずつを尾静脈投与と頸静脈投与にどのように割り当てるのかご教示ください。また、最初から記載させるべきではないでしょうか?
28-4 動物の最大生存(観察)期間(実験上のエンドポイント、安楽死の時期)についてご教示ください。また、最初から記載させるべきではないでしょうか?
28-5 上記4点を含めて、実験内容について、動物への処置の観点からそれぞれの群や条件ごとに時系列でご説明いただけますでしょうか?また、最初からそのように記載させるべきではないでしょうか?
28-6 人道的エンドポイントの記述に、「ラットが苦しむような状況にはならない」とありますが、それではなぜ苦痛カテゴリーがDなのでしょうか?どちらが正しいのでしょうか?動物の苦痛はどの場面で発生するのでしょうか?
28-7 「人道的エンドポイント」と「倫理的エンドポイント」の記載がありますが、どう違うのでしょうか?
以上
<動物実験計画書に関する提言>
貴校において平成23年度から平成25年度までに承認された動物実験計画書を調査した上で、問題点が多いと感じられたものについて改善案を挙げました。提言内容の背景について詳しくは質問書をご参照ください。
●実験目的
機械的な目的だけでなく、研究の科学的、社会的な「意義」を記載させるべき。
●実験方法(実験概要とは別にしても良いし、実験概要の中に設けても良い。)
・実験方法は動物への処置の観点から、実験ごと、群ごとに時系列で説明すべき。(必要に応じて図説や表、フローチャートなども活用すべき。)
・以下を必ず記載させるべき。
○動物への処置の詳細
○各群の条件詳細
○動物モデル(疾患モデル)の作成法
○投与物質の名称、用量、投与経路(部位)、投与期間(回数)、投与間隔(頻度)等
○光線、X線、レーザー等照射の物理条件、照射部位、照射期間(回数)、照射間隔(頻度)等
○動物の予測される症状(有害事象)とその対処法
○実験上のエンドポイント(動物の最大生存/観察期間、安楽死の時期・タイミング)
●使用動物数の算出根拠
実験ごと、群ごとの内訳を必ず記載させるべき。
●麻酔薬
・ペントバルビタール単独とエーテルの使用は避けるべき。(エーテルは安楽死薬としても避けるべき)
・麻酔から覚醒させる時期があるか否か、あるとすればどのタイミングかを必ず記載させるべき。
・どの処置が麻酔下の処置であるかを明確に記載させるべき。
●人道的エンドポイント
動物の苦痛度や侵襲度の高い実験(カテゴリーDなど)では、食欲不振が何日以上、体重減少が何%以上などの客観的指標を設けた上で、条件への合致を遅滞なく判断するために、定期的に動物を観察や測定する具体的プラン(方法、期間、頻度、責任者等)を記載させるべき。その他の実験であっても、できる限り客観的指標を設け、頻繁に動物を観察させるべき。
※なお、一般的な動物の瀕死状態や瀕死の兆候、苦痛やストレスのある状態の判断、見分け方については、申請者(実験者)間で知識の差が生じないように、教育訓練等で十分に認識させるべき。また、いつでも獣医師へ相談できる体制にしておくべき。
※実験終了後の安楽死は実験上のエンドポイントであり、人道的エンドポイントとは明確に区別すべき。
●その他
・動物の死をエンドポイントとする実験(「生命予後の差を見る」、「救命率を見る」等)は基本的に承認すべきでない。(例外的に承認する際は、科学的必然性や妥当性がある場合に限り、人道的エンドポイントを必ず設定させ、条件に合致する際(安楽死)は実験上の「死亡」とみなすことを必須条件とする。)
・基本的事項が書かれていない計画書は、質問への回答を求めるだけでなく、計画書自体を書き直して出し直しさせるべき。
・術後疼痛などに対する鎮痛薬の使用(不可ならその理由も)について記載させるべき。
(質問には入っていないが、記載のある計画書が少なかったため)
以上
<質問書でとりあげた動物実験計画書>
※以下、全て防衛医科大学校で平成23年度から平成25年度までに承認された動物実験計画書から、質問書の番号順に対応する計画書を示す。(メールでの予備審査や動物実験委員会によるコメントなど、計画書の修正内容に関する記録も含む。動物実験実施者名など個人名部分は除いた。)
<質問1>
平成23年度 承認番号11034 研究課題名 マウス皮下腫瘍に対する光―超音波法による分子イメージング
(申請者所属:医用工学講座)



 <質問2>
<質問2>
平成23年度 承認番号11068 研究課題名 頸動脈狭窄症に対する血管内治療の研究
(申請者所属:医用工学講座)




 <質問3>
<質問3>
平成24年度 承認番号12036 研究課題名 光―超音波イメージング法の開発
(申請者所属:医用工学講座)



 <質問4>
<質問4>
平成24年度 承認番号12037 研究課題名 光を用いた膵β細胞からのインスリン分泌促進
(申請者所属:医用工学講座)



 <質問5>
<質問5>
平成22年度 承認番号11004 研究課題名 災害時に発生する出血性ショック心およびクラッシュ症候群に対する人口酸素運搬体を用いた救急救命治療
(申請者所属:研究センター医療工学)




 <質問6>
<質問6>
平成23年度 承認番号11017 研究課題名 キトサンの止血効果について
(申請者所属:医療工学研究部門)



 <質問7>
<質問7>
平成24年度 承認番号12019 研究課題名 脂肪組織及び骨髄由来の細胞を用いた再生医療のための基礎的検討
(申請者所属:医療工学研究部門)


 <質問8>
<質問8>
平成24年度 承認番号12090 研究課題名 キトサンの止血効果と安全性について
(申請者所属:医療工学研究部門)



 <質問9>
<質問9>
平成23年度 承認番号11041 研究課題名 外科侵襲時の生体反応解析とその修飾による予後の改善
(申請者所属:外傷研究部門)








 <質問10>
<質問10>
平成24年度 承認番号12021 研究課題名 細胞増殖因子ファミリー??の神経系における機能の解析
(申請者所属:解剖学講座)



 <質問11>
<質問11>
平成23年度 承認番号11100 研究課題名 自己免疫性ぶどう膜炎モデルマウスの作出と解析
(申請者所属:眼科)




 <質問12>
<質問12>
平成25年度 承認番号13004 研究課題名 出血性ショック蘇生に対する低体温とradical scavengerの相乗効果について
(申請者所属:救急部)



 <質問13>
<質問13>
平成25年度 承認番号13042 研究課題名 外傷時の易出血性病態における人工血小板の適応2
(申請者所属:救急部)


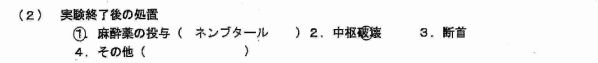

 <質問14>
<質問14>
平成25年度 承認番号13027 研究課題名 皮膚創傷治癒に関する研究
(申請者所属:形成外科)


 <質問15>
<質問15>
平成24年度 承認番号12092 研究課題名 好中球増加・リンパ球減少が腫瘍免疫へ与える影響についての研究
(申請者所属:外科学講座)





 <質問16>
<質問16>
平成23年度 承認番号11007 研究課題名 外科手術の基本学習
(申請者所属:外科学講座)

 <質問17>
<質問17>
平成24年度 承認番号12002 研究課題名 組織特異的な遺伝子導入
(申請者所属:外科学講座(2))



 <質問18>
<質問18>
平成24年度 承認番号12080 研究課題名 重症感染症に対するエンドトキシン吸着療法が免疫機能に与える影響に関する基礎研究
(申請者所属:外科3)





 <質問19>
<質問19>
平成25年度 承認番号13012 研究課題名 周術期炎症反応による免疫抑制の腫瘍増殖への関与に関する研究
(申請者所属:外科学講座)





 <質問20>
<質問20>
平成24年度 承認番号12058 研究課題名 新たなマウス腹腔内癒着モデルの確立とナノシートを用いた癒着防止効果の検討
(申請者所属:外科学講座)






 <質問21>
<質問21>
平成24年度 承認番号12093 研究課題名 肝組織における機能およびバイアビリティ―の光学的診断に関する研究
(申請者所属:外科学講座)







 <質問22>
<質問22>
平成25年度 承認番号13041 研究課題名 動物モデルを用いたPTSDの病態解明およいPTSDの予防と治療に関する研究
(申請者所属:研究センター・行動科学部門)








 <質問23>
<質問23>
平成24年度 承認番号12048 研究課題名 第2学年 感染症系実習「トキソプラズマ」
(申請者所属:国際感染症学講座)



 <質問24>
<質問24>
平成25年度 承認番号13009 研究課題名 麻酔薬による幼弱脳への毒性およびオキシトシンの与える影響について
(申請者所属:産婦人科学講座)




 <質問25>
<質問25>
平成24年度 承認番号12094 研究課題名 内耳障害に対する新しいタンパク治療
(申請者所属:耳鼻咽喉科)


 <質問26>
<質問26>
平成25年度 承認番号13088 研究課題名 内耳音響外傷メカニズムの解明および低出力レーザー照射による治療効果の検討
(申請者所属:耳鼻咽喉科)



 <質問27>
<質問27>
平成25年度 承認番号13078 研究課題名 頭頸部末梢神経障害に対するセンダイウイルスによる遺伝子治療の研究
(申請者所属:耳鼻咽喉科)






 <質問28>
<質問28>
平成25年度 承認番号13028 研究課題名 ラットにおけるセボフルランエマルション静脈内投与の検討
(申請者所属:手術部)









![]() ALIVEの紹介
ALIVEの紹介 ![]() 野生動物
野生動物 ![]() ズー・チェック
ズー・チェック ![]() 家庭動物
家庭動物 ![]() 畜産動物
畜産動物
![]() 動物実験
動物実験
![]() 生命倫理
生命倫理
![]() ライフスタイル
ライフスタイル
![]() 動物保護法
動物保護法![]()
![]() 資料集
資料集 ![]() ビデオ
ビデオ ![]() 会報「ALIVE」
会報「ALIVE」 ![]() 取り扱い図書
取り扱い図書 ![]() 参考図書紹介
参考図書紹介 ![]() リンク
リンク ![]() お問い合わせ
お問い合わせ ![]() 資料請求
資料請求